Anolyte: poderoso biocida
Hay dos soluciones de Anolyto producidos: Anolyte Acid y Anolyte neutro.
Hay dos soluciones de anolito producidos:
El Cloro Activo, contenido nell'Anolyte, es el elemento biocida/bactericida. Su concentración es la misma en las dos soluciones y la única diferencia es el valor pH. Así, en todas las aplicaciones donde hay un problema de corrosión es mejor utilizar el Anolyte Neutro.I
También no hay formación significativa de compuestos de cloro por contacto organico, tales como los trihalometanos y no hay subproducto tóxico de contacto inorgánica tal como Cloritas (ClO2) y Cloratos (ClO3).
Como se puede observar en la tabla, los principales compuestos que se desarrollan dentro del reactor son el ácido hipocloroso y el ión hipoclorito. Los porcentajes no se definen porque su suma es del 0,05% del volumen y están vinculados al valor pH de la solución como se puede observar en la siguiente imagen.
El gráfico muestra un predominio del ácido hipocloroso HClO cuando los valores de pH son inferiores a 7,5, mientras que cuando los valores de pH son más altos, predomina el ión hipoclorito ClO.
Dado que el efecto germicida de HClO es mucho más alto (80-120 veces) que el de los iones de ClO-, es preferible clorar a un pH bajo, lo que resulta en el predominio del ácido hipocloroso (HClO).
Además de estos, también se desarrollan porcentajes muy pequeños: ClO2, HClO3, HClO4, H2O2, O2, O2, ClO2-, ClO3-, O-, HO2-, OH-.
Todos estos componentes hacen de Anolyte Neutral un poderoso bactericida y agente esporicida.
Cl2(g) + H2O --------> HClO + H+ + Cl-
El ácido hipocloroso es débil y se disocia fácilmente en iones de hidrógeno e iones de hipoclorito, como puede verse en la reacción 2:
HClO <---> H+ + OCl- (2)
Cuando se disuelve en agua, se produce la siguiente reacción:
NaOCl + H2O -------> HClO + Na+ + OH-
Por lo tanto, la adición de hipoclorito de sodio al agua produce ácido hipocloroso, similar a la hidrólisis del cloro gaseoso.
Puesto que la adición de hipoclorito de sodio al agua produce iones hidroxilo que aumentan el pH del agua y cualquier exceso de hidróxido de sodio aumenta el pH del agua aún más, el uso de hipoclorito de sodio para la desinfección se vuelve problemático, considerando también la necesidad de utilizar componentes químicos tanto para la producción como para la estabilización de la solución.
La reacción entre hipoclorito de calcio y agua se indica en la siguiente reacción:
Ca(OCl)2 + 2H2O -------> 2HClO + Ca++ + 2OH-
De la reacción se observa que el uso de hipoclorito de calcio en el agua también produce ácido hipocloroso, como en la hidrólisis de cloro gaseoso.
. Similar a la solución de hipoclorito de sódio, la adición de hipoclorito de calcio libera iones de hidroxilo que aumentan el pH del agua.
En primer lugar, al estar en ph 7 se asegura que la proporción de ácido hipocloroso respecto al ión hipoclorito se desplace claramente hacia el ácido hipocloroso, un 80% frente a un 20% de ión hipoclorito, lo que garantiza un alto poder bactericida.
El reactor produce las mismas sustancias biocidas (HClO y ClO-) que los otros agentes desinfectantes pero tiene muchas ventajas: no es tóxico, ni corrosivo ni peligroso, no induce resistencia a las bacterias y elimina/limita la formación de sustancias no deseadas (THMs, Cloritos, Cloratos,...).
Además, la imitación del funcionamiento del sistema inmunológico, o más bien la imitación del comportamiento de los leucocitos (neutrófilos, macrófagos) es particularmente eficaz.
De hecho, las células extrañas son primero fagocitos y luego destruidas por la acción del ácido hipocloroso (HClO), un agente biocida producido por una enzima, la mieloperoxidasa (MPO), empezando por el peróxido de hidrógeno (H2O2) y el ión cloruro de Cl-, durante la explosión oxidativa (estallido respiratorio).

Hay dos soluciones de anolito producidos:
| pH | ORP (mv) | Active Chlorine (mg/l) | |
|---|---|---|---|
| Anolyte Acid | 2.0 - 3.5 | 1000-1200 | 500 - 700 |
| Anolyte Neutro | 5.5 - 8.5 | 700 - 900 | 500 - 700 |
También no hay formación significativa de compuestos de cloro por contacto organico, tales como los trihalometanos y no hay subproducto tóxico de contacto inorgánica tal como Cloritas (ClO2) y Cloratos (ClO3).
Composicìon del Anolyte
| Componente | Simbolo | Cantidad | N° EINECS |
|---|---|---|---|
| Agua | H2O | 99.69% | 231-791-2 |
| Cloruro de sodio | NaCl | 0.26% | 231-598-3 |
| Acido hipocloroso Iòn hipoclorito |
HClO ClO- |
0.05% | 231-959-5 231-668-3 |
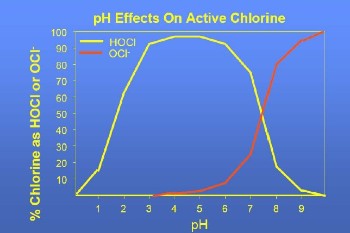
El gráfico muestra un predominio del ácido hipocloroso HClO cuando los valores de pH son inferiores a 7,5, mientras que cuando los valores de pH son más altos, predomina el ión hipoclorito ClO.
Dado que el efecto germicida de HClO es mucho más alto (80-120 veces) que el de los iones de ClO-, es preferible clorar a un pH bajo, lo que resulta en el predominio del ácido hipocloroso (HClO).
Además de estos, también se desarrollan porcentajes muy pequeños: ClO2, HClO3, HClO4, H2O2, O2, O2, ClO2-, ClO3-, O-, HO2-, OH-.
Todos estos componentes hacen de Anolyte Neutral un poderoso bactericida y agente esporicida.
¿Cómo se obtiene tradicionalmente el cloro?
Gas de Cloro
El cloro gaseoso se hidroliza rápidamente en el agua para formar ácido hipocloroso (HClO) con la siguiente reacción de hidrólisis:Cl2(g) + H2O --------> HClO + H+ + Cl-
El ácido hipocloroso es débil y se disocia fácilmente en iones de hidrógeno e iones de hipoclorito, como puede verse en la reacción 2:
HClO <---> H+ + OCl- (2)
Hipoclorito de Sodio
El cloro también se puede obtener del hipoclorito de sodio, que contiene cloro en una concentración del 12,5%.Cuando se disuelve en agua, se produce la siguiente reacción:
NaOCl + H2O -------> HClO + Na+ + OH-
Por lo tanto, la adición de hipoclorito de sodio al agua produce ácido hipocloroso, similar a la hidrólisis del cloro gaseoso.
Puesto que la adición de hipoclorito de sodio al agua produce iones hidroxilo que aumentan el pH del agua y cualquier exceso de hidróxido de sodio aumenta el pH del agua aún más, el uso de hipoclorito de sodio para la desinfección se vuelve problemático, considerando también la necesidad de utilizar componentes químicos tanto para la producción como para la estabilización de la solución.
Hipoclorito de Calcio
El hipoclorito de calcio comercial generalmente contiene 65 por ciento del cloro disponible.La reacción entre hipoclorito de calcio y agua se indica en la siguiente reacción:
Ca(OCl)2 + 2H2O -------> 2HClO + Ca++ + 2OH-
De la reacción se observa que el uso de hipoclorito de calcio en el agua también produce ácido hipocloroso, como en la hidrólisis de cloro gaseoso.
. Similar a la solución de hipoclorito de sódio, la adición de hipoclorito de calcio libera iones de hidroxilo que aumentan el pH del agua.
¿Cómo se puede obtener cloro de manera biológica?
Anolyte neutral
La solución de Anolito neutro con pH 7 permite de resolver muchos de los problemas relacionados con la generación de ácido hipoclorhídrico.En primer lugar, al estar en ph 7 se asegura que la proporción de ácido hipocloroso respecto al ión hipoclorito se desplace claramente hacia el ácido hipocloroso, un 80% frente a un 20% de ión hipoclorito, lo que garantiza un alto poder bactericida.
El reactor produce las mismas sustancias biocidas (HClO y ClO-) que los otros agentes desinfectantes pero tiene muchas ventajas: no es tóxico, ni corrosivo ni peligroso, no induce resistencia a las bacterias y elimina/limita la formación de sustancias no deseadas (THMs, Cloritos, Cloratos,...).
Además, la imitación del funcionamiento del sistema inmunológico, o más bien la imitación del comportamiento de los leucocitos (neutrófilos, macrófagos) es particularmente eficaz.
De hecho, las células extrañas son primero fagocitos y luego destruidas por la acción del ácido hipocloroso (HClO), un agente biocida producido por una enzima, la mieloperoxidasa (MPO), empezando por el peróxido de hidrógeno (H2O2) y el ión cloruro de Cl-, durante la explosión oxidativa (estallido respiratorio).




